Será então o NÚCLEO fundamental? (parte 2)
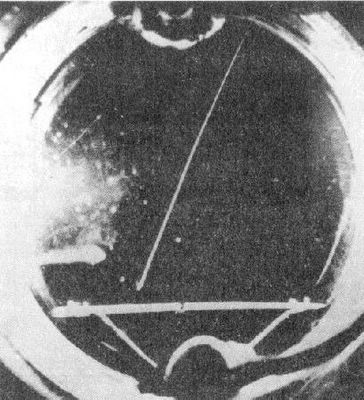
Uma outra pista sobre este aspecto surgiu de experiências de dispersão a. Ernest Marsden questionava-se sobre o que aconteceria se bombardeasse núcleos leves com raios a (ver artigo). Quando, em 1914, aceitou um cargo como professor na Nova Zelândia, deixando assim incompletas as suas investigações (devido à falta do equipamento necessário, indisponível nos laboratórios da sua nova instituição) Rutherford, com quem trabalhara, decidiu prossegui-las ele mesmo. Contudo, a História interveio e fez com que Rutherford só continuasse as experiências quatro anos mais tarde, após o fim da 1ª Guerra Mundial (1918).
Quando fez incidir partículas a sobre nitrogénio gasoso (N2), notou algo estranho: algumas das cintilações que surgiam no seu detector não pareciam provir nem das partículas a nem dos átomos de nitrogénio; pareciam cintilações típicas de núcleos de hidrogénio. Começou por pensar que estes núcleos provinham da fonte de rádio (88Ra) que utilizava como emissor de partículas a. Só posteriormente chegou à conclusão de que afinal provinham dos próprios átomos de nitrogénio! Sucedia que alguns dos átomos de nitrogénio se estavam a desintegrar quando eram atingidos pelas partículas a: Rutherford estava a transformar átomos de nitrogénio (7N) em átomos de oxigénio (8O). A sua experiência convenceu-o de que os átomos de nitrogénio continham núcleos de hidrogénio no seu interior, o que significava que os núcleos de hidrogénio eram partículas fundamentais. Rutherford deu-lhes o nome de protões, do grego "protos" que significa "primeiro".
Rutherford concluiu assim que todos os núcleos deveriam ser constituídos por protões e electrões. As partículas a, ou núcleos de hélio (2He), seriam constituídos por 4 protões e 2 electrões interligados por forças eléctricas. O núcleo de lítio (3Li) teria 7 protões e 4 electrões. E assim sucessivamente...
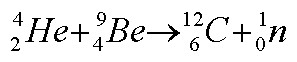
 Por volta de 1900 pensava-se que os átomos eram essas partículas fundamentais, pequenas bolas permeáveis compostas por um fluido carregado positivamente onde se mantinham mais ou menos estáticas pequenas partículas carregadas negativamente: este modelo ficou conhecido pelo caricato nome de Modelo do Pudim de Passas.
Por volta de 1900 pensava-se que os átomos eram essas partículas fundamentais, pequenas bolas permeáveis compostas por um fluido carregado positivamente onde se mantinham mais ou menos estáticas pequenas partículas carregadas negativamente: este modelo ficou conhecido pelo caricato nome de Modelo do Pudim de Passas.



